Laserphysiker des attoworld-Teams der Ludwig-Maximilians-Universität, des Max-Planck- Instituts für Quantenoptik und des Centers for Molecular Fingerprinting haben eine bisher nicht erreichte Kontrolle über Lichtimpulse im mittleren infraroten Wellenlängenbereich erzielt.
Infrarotlicht ist ein Türöffner für vielfältige technologische Anwendungen. Es schafft die Voraussetzungen, Moleküle gezielt zu Schwingungen anzuregen, sowie elektrische Signale in Halbleitern zu erzeugen. Physiker des attoworld-Teams der Ludwig-Maximilians-Universität (LMU), des Max-Planck-Instituts für Quantenoptik (MPQ) und des ungarischen Centers for Molecular Fingerprinting (CMF) ist es nun gelungen, ultrakurze Mittel-Infrarotimpulse zu erzeugen und die Wellenform, also deren elektrisches Feld, präzise zu steuern. Damit eröffnet sich eine ganz neue Möglichkeit der optischen Kontrolle für biomedizinische Anwendungen sowie für die Quantenelektronik. Die Grundlage für die neue Mittel-Infrarotquelle ist ein stabilisiertes Lasersystem, das Lichtpulse mit einer genau definierten Wellenform im angrenzenden nahen Infrarot erzeugt. Die Pulse bestehen aus nur einer Schwingung der Lichtwelle und sind damit nur wenige Femtosekunden lang (eine Femtosekunde ist ein Millionstel einer milliardstel Sekunde, 10-15).
Wer die Schwingung elektrischer Felder von ultrakurzen Lichtimpulsen in Wissenschaft und Technik nutzen will, der muss zunächst herausfinden, wie man sie am besten kontrolliert. In vielen Wellenlängenbereichen klappt das schon gut. Doch es gibt noch Luft nach oben. Wie etwa bei der Kontrolle und Steuerung von Licht im mittleren infraroten Wellenlängenspektrum. Daran haben nun Laserphysiker des attoworld-Teams der Ludwig-Maximilians-Universität, des Max-Planck-Instituts für Quantenoptik und des ungarischen Centers for Molecular Fingerprinting geforscht. Dem Team ist es gelungen, eine Technologie zu entwickeln, die es ermöglicht, die Wellenform und damit das elektrische Feld ultrakurzer Laserpulse im mittleren Infrarotbereich zu kontrollieren. Hierzu wurde zunächst eine neue Laserplattform geschaffen, die höchst reproduzierbare Lichtimpulse im angrenzenden nahen Infrarotspektrum mit einer Wellenlänge von 1 bis 3 Mikrometern und einer Pulsdauer nur weniger Femtosekunden bereitstellt.
Schickt man diese in einen Zink-Germanium-Phosphit-Kristall, so lässt sich in jenem unter Ausnutzung komplexer Mischprozesse die Erzeugung langwelliger Infrarotpulse herbeiführen. Das Team konnte damit eine sehr große Abdeckung des Lichtspektrums von 1 bis 12 Mikrometern erreichen. Dabei konnten die Forscher nicht nur die zugrundeliegende Physik der Mischprozesse erklären, sondern das neue Konzept auch dazu nutzen, die Schwingungen des erzeugten Mittelinfrarot-Lichts über die Eingangsparameter präzise zu kontrollieren.
Diese Kontrolle kann beispielsweise bestimmte elektronische Prozesse in Festkörpern gezielt auslösen, was in zukünftiger, elektronischer Signalverarbeitung wichtig sein und sie extrem beschleunigen könnte. „Man könnte also über die Kontrolle der Lichtpulse eine lichtgesteuerte Elektronik entwickeln. Würden opto-elektronische Bauteile bei Frequenzen des erzeugten Lichts arbeiten, könnte man heutige Elektronik mindestens um den Faktor 1000 beschleunigen“, erklärt Dr. Philipp Steinleitner, einer der drei Erstautoren der Studie.
Ein besonderes Augenmerk der neuen Licht-Technologie legen die attoworld-Physiker auf ihren Einsatz in der Spektroskopie von Molekülen. Trifft nämlich Infrarotlicht auf Moleküle, beginnen diese zu schwingen und senden ihrerseits wieder charakteristisches Licht aus. So kann man herausfinden, welche Moleküle sich in einer Flüssigkeit, wie etwa im menschlichen Blut befinden. „Mit unserer Lasertechnik haben wir damit den kontrollierbaren Wellenlängen-Bereich im Infrarot deutlich erweitert“, erklärt Dr. Nathalie Nagl, ebenfalls Erstautorin der Studie. „Die nun zusätzlich verfügbaren Wellenlängen verschaffen uns die Möglichkeit, noch genauer zu analysieren, wie sich ein Mix aus Molekülen zusammensetzt“, sagt sie weiter.
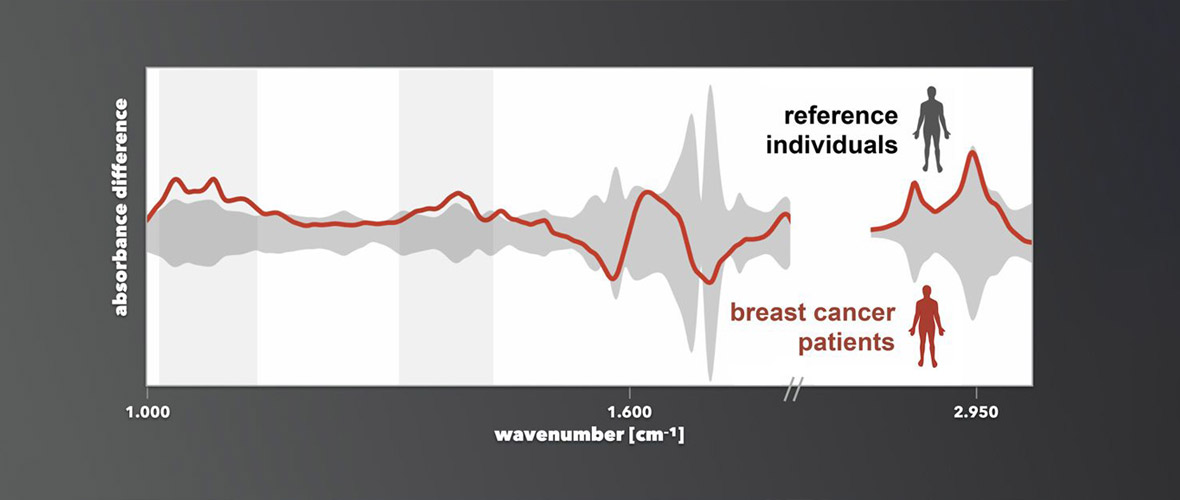
Für das Wissen um die Existenz bestimmter Moleküle im Blut interessieren sich in der attoworld-Gruppe vor allem die Kollegen vom Team Broadband Infrared Diagnostics (BIRD) um Dr. Mihaela Zigman und das CMF Research Team um Dr. Alexander Weigel. Die Teams arbeiten daran, wie man anhand von Molekular-Spektroskopie charakteristische Signaturen —sogenannte Fingerabdrücke — identifizieren kann. Diese erlauben es, eine Erkrankung wie Krebs mittels Blutprobenuntersuchung bereits im Frühstadium zu erkennen. Denn befindet sich in einem Organismus ein Tumor, führt die Erkrankung zu kleinen und äußerst komplexen Änderungen der molekularen Zusammensetzung des Bluts. Diese gilt es zu entdecken, um damit künftig eine frühe Diagnose schwerer Erkrankungen zu ermöglichen. Die Heilungschancen des Patienten werden dadurch deutlich erhöht.
„Unsere Lasertechnologie erlaubt es unseren Kollegen in Zukunft, bisher nicht erfassbare Änderungen spezifischer Biomoleküle wie Proteine oder Lipide nachzuweisen. Damit steigert sie die Verlässlichkeit einer künftigen medizinischen Diagnostik mit Hilfe der Infrarot-Lasertechnologie“, erläutert Dr. Maciej Kowalczyk, ebenfalls Erstautor der Studie.
Bildinformation: Ultrakurze Laserpulse werden in einen nichtlinearen Kristall geschickt und durchlaufen komplexe Frequenz-Mischprozesse. Durch Anpassung der Eingangsparameter des Lasers konnten die Wissenschaftler die Schwingungen des erzeugten Mittelinfrarot-Lichts präzise kontrollieren.
Illustration: Dennis Luck, Alexander Gelin
Originalveröffentlichung:
Philipp Steinleitner, Nathalie Nagl, Maciej Kowalczyk, Jinwei Zhang, Vladimir Pervak, Christina Hofer, Arkadiusz Hudzikowski, Jarosław Sotor, Alexander Weigel, Ferenc Krausz, Ka Fai Mak
Single-cycle infrared waveform control
Nature photonics, 26. Mai 2022
DOI: 10.1038/s41566-022-01001-2
Weitere Informationen erhalten Sie von:
Dr. Nathalie Nagl
Ludwig-Maximilians-Universität München,Lehrstuhl für Experimentalphysik – Laserphysik
Max Planck Institute of Quantum Optics
Am Coulombwall 1, 85748 Garching, Germany
Tel: +49.89.289 53280
Dr. Maciej Kowalczyk
Ludwig-Maximilians-Universität München
Chair for Experimental Physics — Laserphysics
Center for Molecular Fingerprinting
Am Coulombwall 1, 85748 Garching, Germany
Tel.: Tel: +49.89.289 54012
Internet: www.attoworld.de/bird, www.attoworld.de/bird, www.mukkozpont.hu